苏州纳米所张智军团队在功能化金纳米粒子用于间充质干细胞治疗肺纤维化研究方面获进展
特发性肺纤维化(IPF)的发生频率与胃癌及脑癌相似,发病率为每年每10万人中约有18例患者,确诊后死亡率可高达40%,并且仍在上升,给全球人类健康带来了沉重的负担。由于IPF发病机制尚不清楚,目前临床上没有特效药治疗。最近有研究表明,间充质干细胞(MSCs)因具有诱导肌成纤维细胞凋亡、促进肺上皮细胞增殖,以及清除肺间质内细胞外基质的能力,可作为一种新型治疗药物用于重塑IPF患者的肺组织结构,恢复肺泡功能,有效改善IPF治疗效果。然而,IPF的MSCs疗法虽然已经取得了一些重要进展,但是在临床应用方面仍然面临着诸多挑战。IPF患者的恶劣肺纤维化微环境导致移植MSCs存活率低、状态差是影响MSCs疗效的主要障碍。因此,如何提高移植MSCs的存活率、增强其治疗IPF的能力是目前迫切需要解决的难题。
针对该难题,在前期工作基础上 (Biomater. Sci., 2022, 10, 368-375; Small, 2021, 17, 2101861; J. Mater. Chem. B, 2021, 9, 2854-2865; J. Mater. Chem. B, 2020, 8, 1713-1727; Small, 2019, 15, 1904314;Nanoscale, 2019, 11, 20932-20941),中科院苏州纳米所张智军团队设计并构建了一种集可视化示踪和治疗性基因递送于一体的功能化纳米递送载体(图1)。研究人员以硫酸鱼精蛋白(PS)为模板蛋白,合成了PS稳定的金基(AuPS)纳米递送载体。HGF是一种多效性细胞因子,具有抗炎、抗凋亡和促血管生成等作用,尤其具有良好的抗纤维化作用,故而被作为治疗性基因递送到MSCs内。由于AuPS具有优良的膜易位、核定位能力以及良好的质粒装载能力,HGF质粒DNA(HGF pDNA)可以通过AuPS纳米递送载体有效递送至MSCs胞内并高度表达,增强MSCs的抗纤维化能力,并且通过CT信号精确监测MSCs移植到体内后的分布、迁移和归巢等生物学行为。
 图1.(A)AuPS@pDNA的合成;(B)AuPS@pDNA工程化的hMSCs对IPF的治疗机制示意图
图1.(A)AuPS@pDNA的合成;(B)AuPS@pDNA工程化的hMSCs对IPF的治疗机制示意图
在基因递送过程中,负载了HGF pDNA的AuPS(AuPS@pDNA)可以被MSCs有效摄取。此外,AuPS可保护HGF pDNA不被脱氧核苷酸酶I降解,并促进其进入细胞核内表达HGF。据此,过表达HGF的MSCs靶向至肺部纤维化病灶部位,进而通过诱导肌成纤维细胞凋亡,减少肺间质内细胞外基质沉积,逆转肺部纤维化进程,最终修复IPF患者的肺泡功能。同时,移植MSCs内积累的AuPS可以提高其CT成像对比度,能够通过CT成像对移植MSCs进行长达48天的活体实时可视化追踪,从而有助于阐明移植MSCs治疗IPF的机制(图2)。
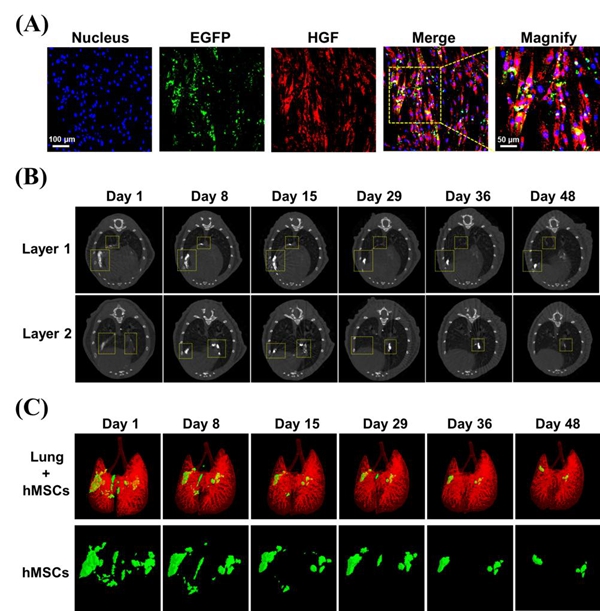 图2.(A)免疫荧光染色分析AuPS@pDNA标记hMSCs内HGF的表达;(B)标记hMSCs移植到IPF小鼠肺部后第1、8、15、29、36和48天的体内Micro-CT成像及其(C)三维 CT成像
图2.(A)免疫荧光染色分析AuPS@pDNA标记hMSCs内HGF的表达;(B)标记hMSCs移植到IPF小鼠肺部后第1、8、15、29、36和48天的体内Micro-CT成像及其(C)三维 CT成像
综上,AuPS纳米递送载体不仅可以在不影响MSCs增殖和分化能力的情况下高效递送HGF pDNA至MSCs内并成功表达,还可以通过CT成像有效示踪移植MSCs在IPF小鼠肺部的分布、迁移和归巢等生物学行为。这种集治疗和可视化于一体的工程化MSCs有望作为一种新型治疗试剂在IPF治疗中应用。
上述成果近期以Functional Au nanoparticles for engineering and long-term CT imaging tracking of mesenchymal stem cells in idiopathic pulmonary fibrosis treatment为题发表于国际学术期刊Biomaterials。苏州纳米所博士生鲍红英为第一作者,张智军研究员与黄洁副研究员为共同通讯作者。相关工作得到国家自然科学基金、中国科学院战略先导科技专项以及中科院国际合作项目等项目支持。
附件下载:
