苏州纳米所程国胜团队J Extracell Vesicles: Ang和TAT双肽修饰的工程化外泌体治疗脑胶质瘤的靶向递送策略
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,我国脑胶质瘤年发病率为5~8/10万,五年病死率在全身肿瘤中仅次于胰腺癌和肺癌,这对人类生命健康产生巨大影响。目前,脑胶质瘤治疗以手术切除为主,但由于肿瘤的高侵袭性、快速生长和增强的血管生成,胶质瘤无法通过传统/常规手术进行干净切除,导致预后不良和生存时间短。针对有效抑制肿瘤生长和延长患者的生存期,化学药物疗法是结合手术切除治疗后最主要的手段之一。然而,胶质瘤细胞对化疗存在内在障碍,同时存在两种生物屏障,即血脑屏障(BBB)和血脑肿瘤屏障,严重阻碍了几乎所有大分子和98%小分子药物进入脑肿瘤区域,极大削弱了化疗的效果。另外,大多数传统抗癌药物本身具有很强的生物毒性,有效的对化疗药物的负载并降低其在运输过程中对个体的生物毒性也是药物递送体系亟需解决的问题。
外泌体是一种由细胞产生的纳米级细胞外囊泡,尺寸在30~150nm,富含来自亲本细胞的蛋白质、核酸和脂质等生物活性成分,在细胞间信号传递中发挥着重要作用。因此外泌体作为一类天然的药物载体,其具有纳米尺寸、可生物降解、无毒、内源性、免疫原性低、载货能力强、能够穿越血脑屏障等优点。然而,外泌体在缺乏特异性修饰的情况下天然的缺乏靶向能力,另外在静脉给药方式下肝脏组织会对无特异性靶向的大部分外泌体进行摄取,导致外泌体药物递送效果大打折扣。因此,迫切需要开发肿瘤特异性和组织器官特异性的靶向递送药物载体,以望提高针对中枢神经系统疾病脑胶质瘤部位的药物浓度,实现增效减毒作用。
近日,中国科学院苏州纳米技术与纳米仿生研究所程国胜研究团队设计开发了Angiopep-2和TAT双重靶向功能化外泌体应用于脑胶质瘤治疗研究。其中Angiopep-2多肽可以特异靶向低密度脂蛋白受体(LRP-1),而LRP-1可同时表达在脑胶质瘤细胞和脑血管内皮细胞表面。另外,跨膜多肽TAT可以进一步提高外泌体血脑屏障的渗透性和肿瘤组织的穿透性。所以,功能化载药外泌体可提高在肿瘤区域治疗药物的浓度,以达到最佳治疗效果(图1)。
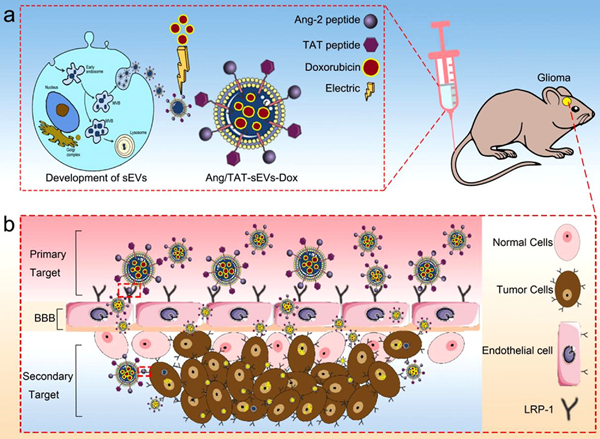 图1. 双功能修饰的外泌体(sEVs)负载化药的递送系统用于治疗脑胶质瘤疾病
图1. 双功能修饰的外泌体(sEVs)负载化药的递送系统用于治疗脑胶质瘤疾病
研究团队分别利用体外单细胞培养、Trans-well构建的体外血脑屏障模型、体内小鼠皮下脑胶质瘤模型和脑胶质瘤原位模型来证实工程化外泌体可以高效渗透BBB并对脑胶质瘤病灶区具有优良的靶向递送能力(图2)。
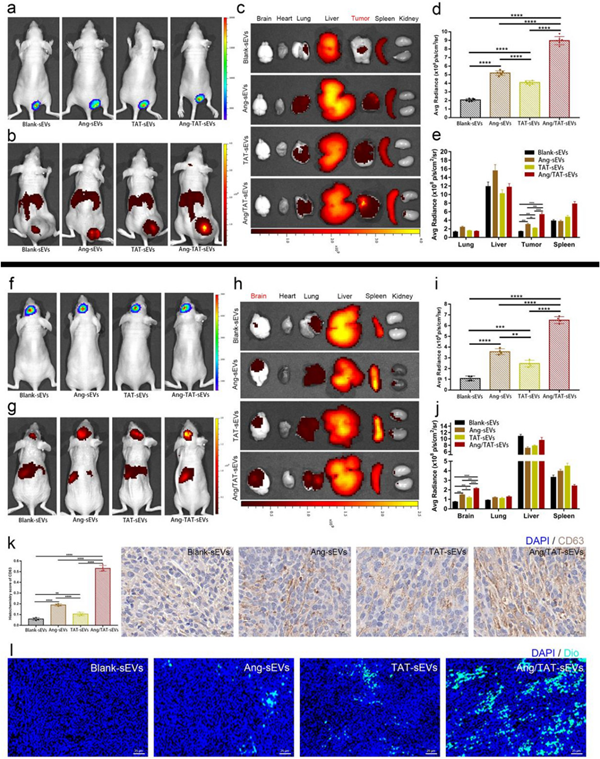 图2. 双肽修饰的外泌体在体内的肿瘤靶向性和BBB渗透性
图2. 双肽修饰的外泌体在体内的肿瘤靶向性和BBB渗透性
此外,为了评估负载阿霉素(Dox)的双功能化的修饰外泌体对原位脑胶质瘤裸鼠中的抗胶质瘤功效。通过尾静脉给药方式对疾病模型小鼠注射负载阿霉素的功能化外泌体,并进行21天的治疗与观察(图3)。团队研究结果发现,双重靶向功能化外泌体能够提高药物治疗原位脑胶质瘤效率,显著地抑制脑胶质的生长,可有效延长小鼠的生存期。同时,双重靶向功能化外泌体可以有效降低药物治疗毒副作用。
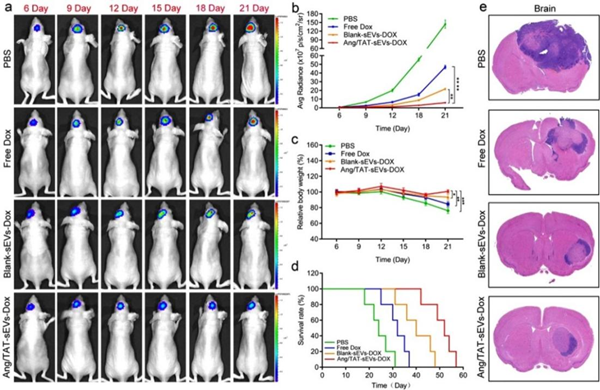 图3. Ang/ TAT-Exos-Dox靶向治疗原位脑胶质瘤模型小鼠
图3. Ang/ TAT-Exos-Dox靶向治疗原位脑胶质瘤模型小鼠
这项工作为外泌体作为一种新颖的药物递送载体在治疗中枢神经系统疾病提供了新思路,也为外泌体未来走向临床提供了展望。同时,研究者也不得不面对现阶段外泌体存在的一些局限性,这些难点也是未来重点研究和突破的方向。
该工作以specific anti-glioma targeted-delivery strategy of engineered small extracellular vesicles dual-functionalised by Angiopep-2 and TAT peptides为题发表在国际细胞外囊泡杂志Journal of Extracellular Vesicals上。论文第一作者为中科院苏州纳米所博士生朱展翅,共同通讯作者为苏州九龙医院马三成主任医师和中科院苏州纳米所杨令延博士、程国胜研究员。该研究得到了广东省基础与应用基础研究基金委重点项目(2019B1515120090)、国家自然科学基金青年基金项目(51903246,31700831)以及江苏省自然科学基金面上项目(BK20201196)支持。
附件下载:
