X-MOL:肿瘤微环境激活型近红外II区荧光纳米诊疗系统用于腹膜转移瘤的精准诊疗
恶性肿瘤仍是目前人类生命健康的重大威胁。基于诊疗一体化理念,新兴发展的纳米诊疗系统将诊断和治疗功能有机结合,相对于单一的诊断或治疗手段具有明显优势。然而,目前大多数报道的纳米诊疗系统,无论是检测信号和治疗药物都始终处于“开启”模式,导致了高的背景信号,极大降低检测的灵敏度,同时药物的脱靶和降解问题会对正常组织造成严重毒副作用。因此,设计具有协同诊断和治疗肿瘤功能的可激活型诊疗系统具有非常重要的临床意义。
中国科学院苏州纳米技术与纳米仿生研究所王强斌团队前期基于高组织穿透深度、高时空分辨近红外II区荧光影像技术发展了Ag2S量子点-多肽自组装体系,有效放大检测目标的荧光信号,实现对0.2 mm直径的肿瘤转移灶精准检测 (Angew. Chem. Int. Ed. 2019, 58, 11001-11006.);同时针对“always-on”荧光探针面临的低检测特异性和灵敏度问题,构建了靶标分子选择性响应的“激活型”近红外II区荧光探针,实现脑机械损伤的精准诊断 (Angew. Chem. Int. Ed. 2020, 59, 247-252.)。在上述工作基础上,近期该团队基于多组分协同自组装策略,针对肿瘤组织特异性微酸环境,发展了一种新型激活型近红外II荧光纳米诊疗系统(FEAD1),实现了对腹膜转移瘤的精确诊断和治疗。该探针首先通过金属配位和静电作用使铒离子Er3 +与Fmoc-His中组氨酸的咪唑基团和MPA-Ag2S 量子点的羧基交联,进一步通过化疗药物阿霉素(DOX)和近红外吸收染料A1094驱动基于多重分子间相互作用(包括疏水相互作用,π-π堆积和静电力)的多组分自组装过程,从而成功构建FEAD1。在正常组织中,由于A1094与Ag2S量子点FRET淬灭效应,FEAD1呈现“Off”状态,同时化疗药物DOX保持惰性;一旦FEAD1进入肿瘤组织,微酸环境引起Fmoc-His上咪唑基团及DOX质子化,弱化了金属配位效应及疏水作用力,触发FEAD1快速解聚,导致荧光由“Off”到“On”及药物分子快速、特异性释放。该可激活策略实现实时、原位、高灵敏监控肿瘤结节的同时能达到高效杀伤肿瘤的效果,显著提高存活率,为临床荧光指导的腹膜转移瘤检测和治疗评估提供了新思路。
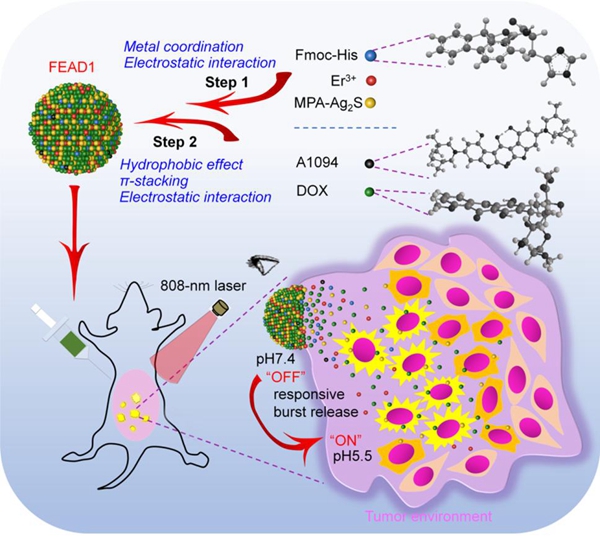
相关工作于近期发表在Angew. Chem. Int. Ed.(2020, DOI: 10.1002/anie.202000947)上。
附件下载:
