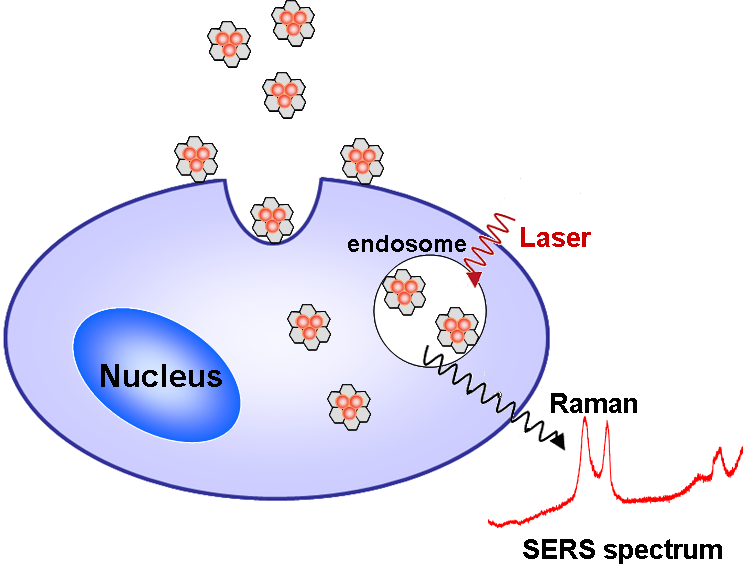
利用SERS技术研究氧化石墨烯细胞内吞机制的示意图
近年来氧化石墨烯(GO)在药物输运、生物传感以及成像等生物医学领域的应用研究受到广泛关注,但有关GO与生物体系的相互作用,尤其是其被细胞内吞的机制一直不清楚。
最近,中国科学院苏州纳米技术与纳米仿生研究所张智军课题组与厦门大学固体表面物理化学国家重点实验室任斌课题组合作,采用表面增强拉曼光谱(SERS)研究了GO的细胞内吞机制。他们首先通过化学偶联的方法将金纳米粒子装载在GO表面,得到金纳米粒子—氧化石墨烯(Au-GO)复合体系。然后以其作为生物相容性SERS活性基底,将Au-GO与Ca Ski细胞共孵育后,利用GO的SERS信号来研究GO进入细胞的过程和机理。
实验发现,GO与细胞共同孵育4h后才能显著进入细胞,而且大都分布在细胞质区域。为了阐明GO的细胞吞噬机制,该研究组考察了chlorpromazine、amiloride、MβCD和NaN3四种抑制剂对GO进入细胞的抑制效果。研究发现,GO进入细胞是通过网格蛋白介导的内吞实现的,而且是一个能量依赖过程。
本研究对于研制基于GO的高效、靶向纳米载药系统和生物传感器,以及阐明GO的生物学效应等具有重要意义。该工作最近发表在Small(2012, 8, 2577-2584)上。
中国科学院苏州纳米技术与纳米仿生研究所研究员张智军:
2004年,英国曼彻斯特大学的Geim等人首次成功制备了世界上唯一的二维纳米材料—石墨烯。该发现引起了轰动,迅速形成了石墨烯研究的热潮。石墨烯独特的二维结构和物化性质使其具有优异的电学、力学和热学性质,在复合材料、传感器、电池等领域有着广泛而重要的应用前景。石墨烯的发现者Geim 和Novoselov也获得了2010年诺贝尔物理学奖。而石墨烯在生物和医学领域的研究是从2008年以后才开始的,其主要包括石墨烯尤其是其衍生物氧化石墨烯在药物递送,生物分子检测和生物组织工程支架材料等方面。
氧化石墨烯由石墨经化学氧化、超声制备而获得,其边缘和基面带有丰富的含氧基团,如羧基、羟基等,使其具有良好的生物相容性、而且易于表面功能化。它还可以方便地通过物理方式吸附难溶性芳香类抗癌药物,石墨烯巨大的比表面使它具有其他纳米材料无可比拟的超高载药率。
2008年美国斯坦福大学戴宏杰课题组首次报道了利用氧化石墨烯作为难溶性含芳香结构抗癌药物的载体。他们研究发现,负载抗癌药物的氧化石墨烯复合物有良好的水溶性,可以用于难溶性药物的增溶,并可以有效杀伤肿瘤细胞。此后这方面的研究引起了人们越来越多的兴趣。据统计,2008年氧化石墨烯作为纳米药物载体的文章只有30篇左右,而2012年前7个月氧化石墨烯用于载药的文章已超过250篇,充分显示该研究领域迅猛蓬勃的发展趋势。
但是氧化石墨烯是如何进入细胞的,也就是氧化石墨烯的细胞内吞机制一直不清楚。中科院苏州纳米所张智军课题组与厦门大学固体表面物理化学国家重点实验室任斌课题组合作,首次采用表面增强拉曼光谱等手段对氧化石墨烯进入细胞的机制进行了研究。与生物研究中常用的荧光标记方法相比,利用表面增强拉曼光谱获得的是氧化石墨烯本身的信号而非标记分子的信号,这有利于我们更直接、更准确地检测细胞内氧化石墨烯分布。
通过对活细胞内氧化石墨烯的拉曼光谱研究发现,氧化石墨烯与细胞共同孵育4小时后才能显著进入细胞,而且大都分布在细胞质区域。同时我们还发现,氧化石墨烯进入细胞是通过由网格蛋白介导的细胞内吞作用实现的,并且是一个能量依赖过程。简单来说,就是氧化石墨烯首先在细胞表面形成包被小窝,细胞脂膜内陷,包被小窝从细胞膜上脱落下来,使氧化石墨烯进入细胞内。
阐明氧化石墨烯的细胞内吞机制可以更有效地指导我们在基于氧化石墨烯的高效、具有生物靶向的纳米载药系统和生物传感器等的研究,同时也有助于深入了解这一新型二维纳米材料与生物体的相互作用,尤其是氧化石墨烯的生物毒性,从而最大限度发挥其在生物医学领域中的应用,指导我们避免或减少在石墨烯生产、加工和使用过程中可能产生的健康和环境风险。
(原载于《中国科学报》 2012-10-16 B2 生物)